Batterien Warum Lithium-Ionen-Akkus explodieren können
Lithium-Ionen-Akkus haben den großen Nachteil, dass sie explodieren können. Wie genau es dazu kommt, haben jetzt zwei Chemiker der Universität Ulm herausgefunden.
Anbieter zum Thema

Smartphones, Laptops, E-Autos: Lithium-Ionen-Akkus sind in vielen Gegenständen unseres Alltags verbaut. Ihr größter Vorteil: Sie sind extrem leistungsfähig. Allerdings besteht bei ihnen auch die Gefahr von explosiven Batteriebränden.
Die Auslöser der Brände sind oftmals astartige Auswüchse, die beim wiederholten Aufladen der Akkus entstehen können – sogenannte Dendriten. Bisher wusste man allerdings nicht, warum Metalle wie Lithium Dendriten bilden, aber Silber und Kupfer dagegen nicht. Die Chemiker Prof. Wolfgang Schmickler und Dr. Elizabeth Santos der Universität Ulm haben diese Frage nun geklärt.
Wie die Dendrite gebildet werden
Um die Kurzschlüsse bei Lithium-Ionen-Akkus, die gefährliche Brände auslösen können, zu verhindern, werden die Lithium-Ionen in Graphit eingelagert. Das allerdings erhöht Volumen und Gewicht der Akkus, was etwa bei der E-Mobilität zu weniger Reichweite führt.
Batterien mit einer reinen Lithium-Elektrode hätten zwar eine deutlich höhere Energiedichte, neigen jedoch zur Dendritenbildung. Diese astartigen Auswüchse entstehen allmählich beim Aufladen der Batterie an der negativen Elektrode. Wenn sie die Gegenelektrode erreichen, können diese Dendriten im Zusammenspiel mit entflammbaren Elektrolyten einen Kurzschluss verursachen – die Batterie brennt ab.
Mit Supercomputer den Dendriten auf der Spur
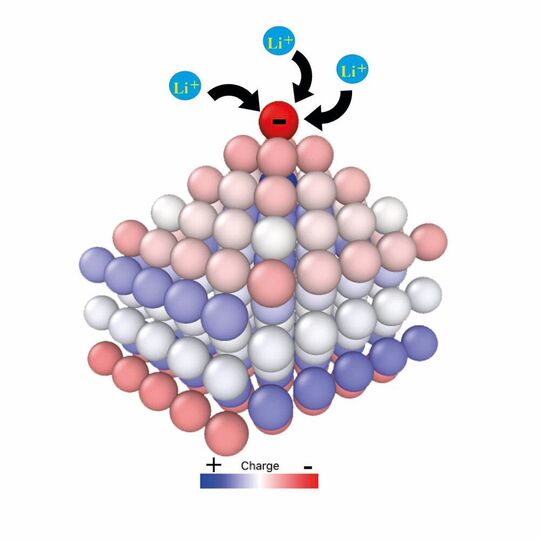
Auf dem Ulmer Supercomputer „Justus 2“ haben die Forschenden quantenchemische Berechnungen mithilfe einer Weiterentwicklung der „Density-functional Theory“ durchgeführt. Ihre Ergebnisse legen folgendes Szenario für die Dendritenbildung nahe: Jedes Metall verfügt über einen sogenannten Ladungsnullpunkt. Wird das Metall bei Potentialen unterhalb dieses Ladungsnullpunkts – also bei einer negativ geladenen Elektrode – abgeschieden, entstehen die kristallartigen Dendriten.
Bei dieser Abscheidung bilden sich immer wieder kleine Unebenheiten wie Vorsprünge auf der Oberfläche. Den Gesetzen der Elektrostatik folgend, konzentriert sich die negative Ladung auf den Spitzen solcher Cluster und zieht die positiv geladenen Lithium-Ionen an. „Somit wachsen diese Spitzen weiter und bilden schließlich Dendriten“, erklärt Professor Schmickler.
Darüber hinaus konnten die Forschenden ein weiteres Phänomen nachweisen, das zur Dendritenbildung beiträgt: Die negative Ladung verkleinert die Oberflächenspannung und fördert damit die Entstehung von Vorsprüngen auf der Oberfläche. Santos und Schmickler vergleichen diesen Vorgang mit Spülmittel, das die Bildung von Blasen im Wasser erleichtert.
:quality(80)/images.vogel.de/vogelonline/bdb/1674200/1674211/original.jpg)
Tag der Batterie
Die Entwicklung der ersten Batterie
Warum Kupfer keine Dendriten bildet
Diese Erkenntnisse sind kompatibel mit bisherigen Forschungsergebnissen. Allerdings haben Schmickler und Santos mit ihren Berechnungen erstmals ein Modell auf atomarer Ebene entwickelt. Dieses lässt sich auf andere Metalle übertragen und erklärt gleichzeitig, warum beispielsweise Kupfer keineswegs anfällig für Dendriten ist.
Dr. Elizabeth Santos erläutert: „Bei Metallen wie Kupfer oder Silber ist die Oberfläche bei der Abscheidung positiv geladen. Bildet sich dort ein kleiner Vorsprung auf der Oberfläche, sammelt sich eine positive Ladung an. Diese stößt die positiv geladenen Metall-Ionen ab, das Cluster kann nicht weiter wachsen und Dendriten bilden.“
Dendriten-Bildung in Batterien vermeiden

Die Ergebnisse der Chemiker sind zunächst in der Theorie relevant, da sie in dem Modell zeigen können, warum einige relevante Materialien Dendriten bilden und andere nicht. Darüber hinaus liefern sie eine Erklärung für die Entstehung der Kristallstrukturen auf atomarer Ebene.
Das Modell sagt auch voraus, wie sich die Bildung von Dendriten in aufladbaren Batterien vermeiden lässt, allerdings betonen die Autoren: „Hierfür wäre ein Lösungsmittel erforderlich, das widersprüchliche Anforderungen erfüllt. Daher haben unsere Ergebnisse zunächst vor allem theoretische Relevanz.“
Bei ihrer wissenschaftlichen Arbeit wurden Santos und Schmickler von der Deutschen Forschungsgemeinschaft (DFG) und Conicet unterstützt, dem nationalen Rat für wissenschaftliche und technologische Forschung in Argentinien. Der wissenschaftliche Beitrag ist in der Fachzeitschrift „Angewandte Chemie“ erschienen.
:quality(80)/images.vogel.de/vogelonline/bdb/1497000/1497058/original.jpg)
Batterie
So findet man die richtige Batterietechnologie
(ID:47154533)





:quality(80)/p7i.vogel.de/wcms/81/f4/81f4059bfe941824c97f99be96ae845f/0118306598.jpeg)
:quality(80)/p7i.vogel.de/wcms/3f/b2/3fb26b53f8d1b93331b167bb364607b3/0118140787.jpeg)
:quality(80)/p7i.vogel.de/wcms/45/a4/45a4b713415b52dc0ee15c4f314b440f/0118240803.jpeg)
:quality(80)/p7i.vogel.de/wcms/be/e9/bee9b7f2fc8eff621090186fb974c724/0118233697.jpeg)
:quality(80)/p7i.vogel.de/wcms/05/5e/055ef66d89c7c08f35c6818f8e4706e5/0118214294.jpeg)
:quality(80)/p7i.vogel.de/wcms/0a/05/0a059f86e3cbc47d8a0d62ca6a4b5777/0118139352.jpeg)
:quality(80)/p7i.vogel.de/wcms/07/f5/07f5d35471782de91638b6768050f7d4/0118209299.jpeg)
:quality(80)/p7i.vogel.de/wcms/dd/4b/dd4bf08415e064223ceaf307e0798b5a/0118215159.jpeg)
:quality(80)/p7i.vogel.de/wcms/a0/2f/a02f776411e7afcb905dac4488eb72fd/0118200247.jpeg)
:quality(80)/p7i.vogel.de/wcms/da/d6/dad668ca23c067047c74b957ebc77cfb/0118217241.jpeg)
:quality(80)/p7i.vogel.de/wcms/94/ca/94ca00b46b0582b33dc2d6ad1011d771/0117811816.jpeg)
:quality(80)/p7i.vogel.de/wcms/b0/60/b060e3c65b7c1bde72f24d1cef1c679b/0118279711.jpeg)
:quality(80)/p7i.vogel.de/wcms/94/5d/945d8cd7818b9a676bf8ad44c70c4db2/0118304967.jpeg)
:quality(80)/p7i.vogel.de/wcms/a1/37/a137564025c84da74158417353716ce8/0118196656.jpeg)
:quality(80)/p7i.vogel.de/wcms/56/8c/568c3ae38e015fdff7abb4e9c7dc4c56/0118268806.jpeg)
:quality(80)/p7i.vogel.de/wcms/70/4a/704a3d049ceab37d1d13620307ce6ff5/0118266157.jpeg)
:quality(80)/p7i.vogel.de/wcms/19/f1/19f18701c799cf03190f7ce53cac95ea/0118237593.jpeg)
:quality(80)/p7i.vogel.de/wcms/20/6b/206b18621cd184e3565717bc66bab778/0118183581.jpeg)
:quality(80)/p7i.vogel.de/wcms/ad/b4/adb4c3b436598a5ef743b4db4492fb67/0117784535.jpeg)
:quality(80)/p7i.vogel.de/wcms/54/20/5420157c70e35d91f624781222153ec9/0118161790.jpeg)
:quality(80)/p7i.vogel.de/wcms/4f/2e/4f2ed6466d663353a5902fe7d9b108f1/0117788581.jpeg)
:quality(80)/images.vogel.de/vogelonline/bdb/1651700/1651739/original.jpg)
:quality(80)/images.vogel.de/vogelonline/bdb/1649900/1649964/original.jpg)
:quality(80)/images.vogel.de/vogelonline/bdb/1633100/1633135/original.jpg)
:fill(fff,0)/images.vogel.de/vogelonline/companyimg/113400/113491/65.gif)
:fill(fff,0)/p7i.vogel.de/companies/62/05/6205371fbd768/pflitsch-logo-rgb.png)
:quality(80)/p7i.vogel.de/wcms/91/8a/918a8d37d954bcc97de082b7fbfc7230/0115140553.jpeg)
:quality(80)/p7i.vogel.de/wcms/48/44/48448f94d41f9bb58f5d7791fc6dee6e/0117003119.jpeg)