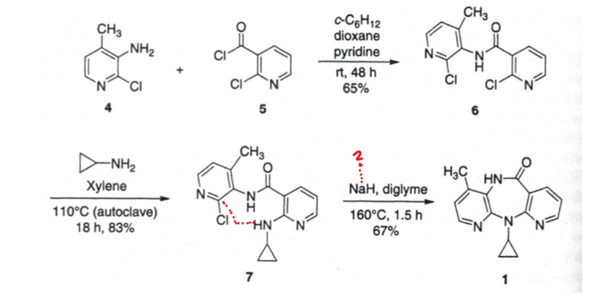
-NH2 substituiert -Cl am Pyrimidin, soweit klar. Detailfrage: Wieso NaH? Selber Mechanismus?
Ich wieder (ja ich schreib ne Klausur). :)
Gefragt sind die Mechanismen für die C-N Kupplungen (5 zu 6, 6 zu7 und 7 zu 8)
Beim letzten Schritt wird NaH verwendet, was ja schon etwas heftiger ist.
Und dann noch 160°C.
Der Mechanismus NH2 mit Cl ist soweit klar, aber ist der letzte Schritt nach selben Mechanismus? Da ein Hydrid anwesend ist, mutmaße ich, dass es da anders ablaufen muss. Oder geht das nach dem selben Mechanismus..?
Wenn ja, wieso sind die Reaktionsbedingungen so heftig?
Experten ihr seit gefragt!
Danke schonmal!
2 Antworten

Natriumhydrid ist zwar eine Starke Bsse, aber eine Deprotonierung wird hier nicht auftreten.
Jedoch muss etwas beachtet werden. In Gegenwart von Diglyme, wird NaH meines Erachtens sich wie Na+ und H- verhalten. Dies ist der Schlüssel. Du wirst hier aller Wahrscheinlichkeit kurzfristig einen Komplex haben, bei dem Diglyme ein Intermediat koordiniert und dann am Ende (!) NH2 am Cyclopropylrest entsteht. Im Verlauf wird dann der Ringschluss stattfinden und Wasserstoff abgespalten, während das Na Atom weiter koordiniert bleibt und ggf. sogar den komplex stabilisieren könnte.

Das ist selbst hergeleitet mit Wissen ;). Für gewöhnlich reagieren Metallhydride, wie Metall plus Wasserstoff. Ein Metallkation ist dabei oft zuständig zur Stabilisierung eines Intermediates. Schau Dir mal die Bedingungen an und erinnere Dich daran dass thermodynamisch oder kinetisch günstige Produkte entstehen können.
Dann schau Dir mal das C-Atom links am arom. Ring an, wo das Cl dran hängt. Geh mal davon aus, dass dies partiell positiv geladen ist. In der Folge wird das ein gutes Nukleophil darstellen. Die Reaktion des Hydrides mit mer NH-Gruppe wäre das einzig Sinnvolle. Andererseits ist der Ansatz, dass NaH hier als starke Base, dort ein Proton abstrahiert, durchaus denkbar.
Dazu muss man sich aber mal anschauen, ob die negative Ladung dann am Stickstoff stabilisiert werden kann (Resonanzstrukturen!).
Je besser die Ladung stabilisiert werden kann, desto wahrscheinlicher ist es, dass dort auch eine auftritt. Stickstoff alleine ist ein kleines Atom und eine Ladung dort wäre sehr ungünstig. Ergibt das Sinn für Dich?

Um ein Carbanion zu erzeugen, wie es BuLi an Halogenaromaten vermag, reicht die Basenstärke des NaH nicht aus. Wir haben es also mit einer nukleophilen aromatischen Substitution zu tuen.
Der Cyclopropylring ist höchstwahrscheinlich nicht beteiligt, obwohl man das aufgrund von teilweisem sp2-Verhalten denken könnte. Am ehesten vermute ich, dass das Amin deprotoniert wird. Eine Triebkraft ist durch Wasserstoffentzug vorhanden. die pKb-Werte des Hydrids und NH2- sind -25 und -21.
Der Benzinmechanismus versagt hier, der Birch-like mit Na/NH3 verläuft. SnAr besitzt generell noch mehrere andere mögliche, sehr, sehr komische Mechanismen. https://en.wikipedia.org/wiki/Nucleophilic_aromatic_substitution
Einschätzen, ob es sich um einen gängigen Syntheseweg der Benzodiazepine handelt, kann ich nicht. In der Tat sind diese Reaktionsbedingungen (150 °C, extrem starke Base, H2-Gas, Diglym als Na-Ligand) extrem harsch.
Aber warum zum verfickten Fickfick stellt man solche Fragen Sonntags um 4 Uhr morgens?
Woher um Guguck soll man das wissen, wenn das nicht behandelt wurde *lach*
Danke für deine Antwort.
Hättest du etwas wo man das nachlesen könnte?