Redoxreaktionen (O,Cl)?
Warum bekommt Sauerstoff bei einer Reduktion 4 Elektronen und Chlor nur 2 Elektronen wenn beide Gase doch molekular vorliegen?
3 Antworten

Weil Sauerstoff als Element der VI. Hauptgruppe, auch genannt Chalkogene, 6 Valenzelektronen auf der äußeren Schale hat und zur Erlangung der Edelgaskonfiguration 2 weitere benötigt. Das Sauerstoffmolekül besteht aus 2 Sauerstoffatomen, denen also je 2 Elektronen fehlen, macht in der Summe also 4 Elektronen. Chlor steht in der VII. Hauptgruppe der Halogene. Es hat 7 Valenzelektronen und benötigt also pro Chloratom ein weiteres, um Edelgaskonfiguration zu erlangen. Ein Molekül aus 2 Cl-Atomen benötigt also zur Reduktion zum Chlorid 2 Elektronen.
O₂ + 4 e⁻ ---> 2 O²⁻
Cl₂ + 2 e⁻ ---> 2 Cl⁻

Chlor- und Sauerstoffatome - Edelgaskonfiguration/Oktettregel
Das Ziel der Atome ist es die Edelgaskonfiguration zu erreichen.
Das heißt, dass die Atome 8 (Wasserstoff, Helium, Lithium, ... nur 2) Valenzelektronen (= Elektronen in der äußersten Schale) anstreben.
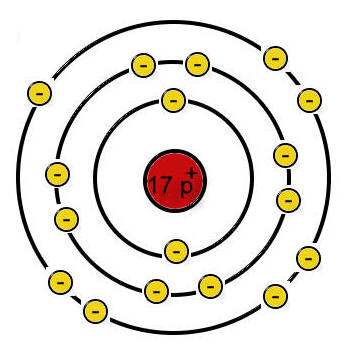
Chlor steht in der 7. Haupgruppe, weswegen es auch 7 Valenzelektronen aufweist, das heißt, dass ein Chloratom genau 1 Elektron aufnehmen muss, damit es die Edelgaskonfiguration erreicht.
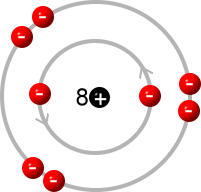
Sauerstoff steht in der 6. Hauptgruppe, weswegen es auch 6 Valenzelektronen hat, weswegen ein Sauerstoffatom 2 Elektronen aufnehmen muss, damit es die Edelgaskonfiguration erreicht.
Chlor und Sauerstoff könnten natürlich auch die Edelgaskonfiguration erreichen, indem sie all ihre Valenzelektronen abgeben, das passiert aber nicht, da es energetisch viel günstiger ist, einfach 1 Elektron (Sauerstoff 2 Elektronen) aufzunehmen, anstatt 7 Elektronen (Sauerstoff 6 Elektronen) abzugeben.
Die einzelnen Atome sehen im bohrschen Atommodell wie folgt aus, wobei die Elektronenbesetzung nochmals verdeutlicht wird, damit du dir das Ganze besser vorstellen kannst.
Chloratom:
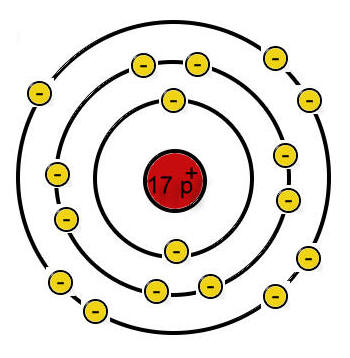
(Quelle: https://chemiezauber.de/inhalt/basic-2-kl-8/salze-1/chlor-und-natrium/481-chlor.html)
Sauerstoffatom:
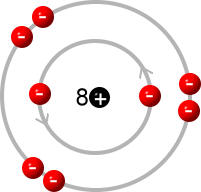
(Quelle: https://chemiezauber.de/inhalt/basic-1/ein-neues-atommodell-muss-her/das-schalenmodell.html)
Chlor- und Sauerstoffmoleküle
Die von dir genannten Elemente liegen beide molekular vor, wobei die Moleküle jeweils aus zwei Atomen bestehen.
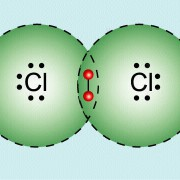
Hierbei liegt dann jeweils eine kovalente Bindung vor, wobei die Valenzelektronen sozusagen geteilt werden, damit beide Stoffe die Edelgaskonfiguration erreichen.
Auf der Teilchenebene würde das Ganze dann wie folgt aussehen:
Chlormolekül:
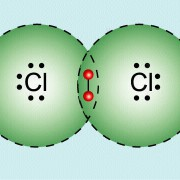
(Quelle: https://www.lernhelfer.de/schuelerlexikon/chemie/artikel/atombindung)
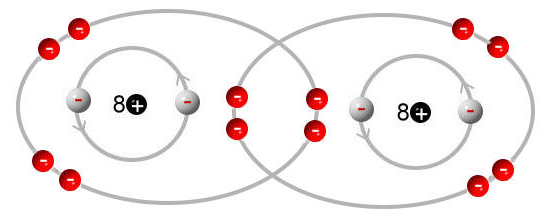
Sauerstoffmolekül:
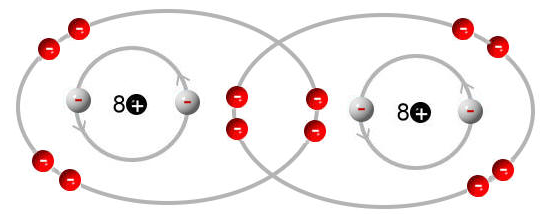
Wenn wir jetzt sozusagen die Atome voneinander trennen, dann benötigen beide Atome eine entsprechende Anzahl an Elektronen, damit diese die Edelgaskonfiguration erreichen.
Das Chloratom bräuchte hierbei 1 Elektron, damit es die Edelgaskonfiguration erreicht, da aber zwei Chloratome vorliegen, werden insgesamt 2 Elektronen benötigt.
Das Sauerstoffatom bräuchte dabei 2 Elektronen, damit es die Edelgaskonfiguration erreicht, da aber auch hier wieder zwei Sauerstoffatome vorliegen, werden insgesamt 4 Elektronen benötigt.
Reaktionen
Damit das Ganze nochmals deutlicher wird, zeige ich dir das Ganze anhand der Reaktion von Magnesium mit den oben genannten Stoffen.
Magnesium hat hierbei 2 Valenzelektronen, welche es abgeben kann, damit es die Edelgaskonfiguration erreicht.
Reaktion von Magnesium mit...
...Chlor:
Wir haben hierbei 2 Chloratome gegeben, welche zusammen zwei Elektronen aufnehmen können und wir haben ein Magnesiumatom, welches zwei Elektronen abgeben kann, weswegen die Reduktion, Oxidation und Redoxreaktion wie folgt aussehen:
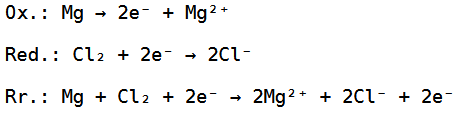
Bei der Redoxreaktion können die 2 Elektronen noch weggekürzt werden, habe ich aber, damit das Ganze einfacher nachzuvollziehen ist, nicht gemacht.
Die Gesamtreaktionsgleichung würde dann folgendermaßen aussehen:
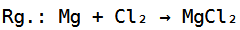
Die Reaktionsgleichung ist somit ausgeglichen, wobei die Edukte Magnesium und Chlor zum Produkt Magnesiumchlorid reagieren.
Das Ganze kann man noch wie folgt veranschaulichen:
(Quelle: http://www.gcsescience.com/a9-reaction-magnesium-chlorine.htm)
...Sauerstoff:
Jetzt haben wir ein Sauerstoffmolekül gegeben, welches aus zwei Sauerstoffatomen besteht, wobei ein Sauerstoffatom zwei Elektronen aufnehmen kann, während das Magnesiumatom zwei Elektronen abgeben kann.
Da wir hier aber zwei Sauerstoffatome haben, brauchen wir nochmals zwei Elektronen, weswegen wir noch ein zweites Magnesiumatom brauchen.
Die Reduktion, Oxidation und Redoxreaktion sehen deswegen wie folgt aus:
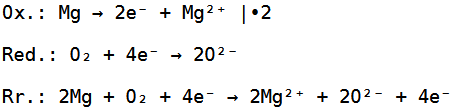
Die Gesamtreaktionsgleichung sieht dementsprechend so aus:
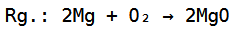
Auf der Teilchenebene kann man sich das dann wieder ungefähr folgendermaßen vorstellen:
(Quelle: http://chemistry.elmhurst.edu/vchembook/143Amgoxide.html)
(Habe hierfür leider keine allzu gute Grafik bekommen)
Jetzt ist hoffentlich klar, wie das Ganze mit den Elektronen zu Stande kommt.
~Johannes
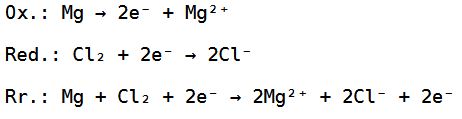
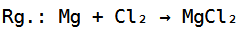
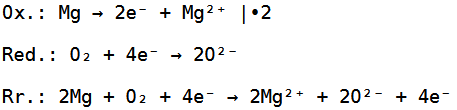
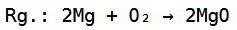

Ich musste aufgrund eines Limits 2 Grafiken rausnehmen. Der Link steht aber dann da.
~Johannes

Weil Sauerstoff in der 6. Hauptgruppe und zweiwertig ist, während Chlor in der 7. HG und einwertig ist!

Wieso denn einwertig?