pH-Wertänderung von Kristallviolett - Helmholtz Gymnasium Bonn
pH-Wertänderung von Kristallviolett - Helmholtz Gymnasium Bonn
pH-Wertänderung von Kristallviolett - Helmholtz Gymnasium Bonn
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Versuchsprotokoll: Eigenschaften <strong>von</strong> <strong>Kristallviolett</strong> bei <strong>pH</strong>-Wert – Änderungen (http://www.bautschweb.de/chemie/kristallviolett/kristallviolett.htm)<br />
Durchführung:<br />
20 Milligramm <strong>Kristallviolett</strong> werden in 500ml einer einmolaren Salzsäure gelöst. Je 100ml da<strong>von</strong> werden mit 1m Natronlauge bis zu den <strong>pH</strong>-Werten 1, 1,35, 2,2, ca. 11 und 13 titriert. Die Mischung ist<br />
wieder auf 100ml mit Wasser aufzufüllen. In einem 6. Becherglas löst man eine große Spatelspitze (ca. 100mg) <strong>Kristallviolett</strong> direkt in 100ml 15%iger Salzsäure. Das Milieu wird mit einem <strong>pH</strong>-Meter<br />
bestimmt. Die Farbe wird vor einer Milchglasscheibe mit Halogenlampen-Hintergrund und nach erfolgtem Weißabgleich mit einer DSLR-Kamera dokumentiert. Ein digitales Spektralfotometer ermittelt<br />
die Extinktionskurve.<br />
Achtung: Die konzentrierten Säuren und Laugen sind sehr ätzend!<br />
Beobachtungen bei Zugabe <strong>von</strong> Natronlauge<br />
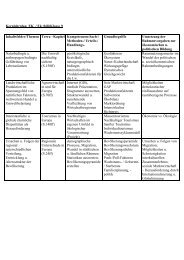
Kolben: I II III IV V VI<br />
Konzentration: ca. 2,5 mmol/l 0,1 mmol/l 0,1 mmol/l 0,1 mmol/l 0,1 mmol/l 0,1 mmol/l<br />
Milieu: extrem sauer stark sauer<br />
schwach sauer bis schwach<br />
basisch<br />
stark basisch<br />
gemess. <strong>pH</strong>: -1,10 1,00 1,35 2,20 11,7 13<br />
Foto<br />
sichtbare<br />
Farbe<br />
orange<br />
(bei 0,1mmol / und <strong>pH</strong> 0: gelb!)<br />
grün blaugrün blau violett farblos<br />
VIS<br />
Spektrum<br />
Messwerte<br />
hier als<br />
Excel-File<br />
Maxima<br />
im Fotometer<br />
Absorbierte<br />
Farbe<br />
Deutung:<br />
420 425 + 625 590<br />
violett (+ blau) rot + violett rot (+ violett) gelb gelbgrün UV-Bereich
Struktur der<br />
Teilchen:<br />
gleichwertige<br />
Grenzstrukturbereiche<br />
sind gelb<br />
hinterlegt<br />
Gemisch<br />
Gemisch<br />
Effekte: Bathochromie ===========================================><br />
Ergebnis:<br />
Alle drei Auxochome sind durch die<br />
Protonierung deaktiviert. Die<br />
Mesomerie begrenzt sich auf das<br />
zentrale C-Atom und die<br />
Phenylringe. Das Gelb hat ein breites<br />
Absorptionsband und wirkt bei hoher<br />
Konzentration durch Hyperchromie<br />
orange!<br />
Gemisch aus Struktur<br />
I und III<br />
Der pKs-Wert liegt<br />
laut Literatur* bei 0,8<br />
Die tiefste, denkbare Farbe wird <strong>von</strong><br />
diesem, relativ kleinen Molekül<br />
erzeugt.<br />
Zwei gleichwertige Grenzstrukturen<br />
(ein T-Chromophor) und ein kaum<br />
vom unteren Phenylring<br />
beeinflusstes, zentrales C-Atom<br />
bilden eine besonders geringe<br />
Differenz zwischen bindenden<br />
(HOMO) und antibindenden<br />
(LUMO) Pi-Orbitalen.<br />
Hypsochromie<br />
===========================================><br />
Gemisch aus Struktur<br />
III und IV<br />
Der pKs-Wert liegt<br />
laut Literatur* bei 2,6<br />
das zentrale C-Atom ein<br />
Das System enthält noch ein weiteres,<br />
Hydroxidion addiert hat<br />
wirksames Auxochrom, die NN-<br />
(Carbinolbase). Die sp3-<br />
Dimethylaminogruppe unten (ein Y-<br />
Hybridisierung hier<br />
Chromophor). Trotzdem steigt die<br />
verhindert den Verbund<br />
Farbe wieder an. Das wird mit der<br />
Elektronendichtewirkung des unteren<br />
Systems auf das zentrale C-Atom<br />
gedeutet.<br />
Die Delokalisation der Pi-<br />
Elektronen ist jetzt auf die<br />
Benzolringe beschränkt, da<br />
der delokalisierten Pi-<br />
Elektronensysteme. Die<br />
Absorption<br />
elektromagnetischer<br />
Wellen liegt außerhalb des<br />
sichtbaren Bereichs im<br />
UV.<br />
<strong>Kristallviolett</strong> zeigt bei der Protolyse ein Kaleidoskop <strong>von</strong> Farben. Ursache sind drei Auxochrome Gruppen, die das delokalisierte Pi-Elektronensystem in seinem Energieniveau<br />
beeinflussen. Gibt das Trikation ein Proton ab kommt eine farbvertiefende Gruppe mit positiv-mesomeren Effekt dazu, entsteht ein sehr energiearmes blaugrünes System. Wird durch<br />
erneute Deprotonierung ein weiteres Auxochrom aktiviert, ergibt sich eine intensive, violette Farbe. Im stark basischen Bereich zerstört die Anlagerung <strong>von</strong> Hydroxidionen die<br />
Wechselwirkung mit sichtbarem Licht.