För att beskriva kemiska reaktioner använder kemister ofta så kallade reaktionsformler. Dessa kommer du att lära dig ställa upp och tolka om du läser kemi på gymnasiet, men även inom högstadiekemin är det bra att ha lite koll på dem. I den här artikeln får du därför grundläggande genomgång.
Att skriva en reaktionsformel
Reaktionen som vi beskrev i förra artikeln kan beskrivas med ord. ”Vätgasmolekyler och syrgasmolekyler reagerar och bildar vatten” fungerar utmärkt att skriva, men det blir inte så överskådligt.
Ett smidigare sätt är att använda en så kallad reaktionsformel, som i detta fall skulle bli
\( \mathrm{V\ddot{a} tgas\: +\: Syrgas\: \longrightarrow\: Vatten\,.}\)
Som du ser skriver man reaktanterna till vänster och produkterna till höger (den inbördes ordningen spelar dock ingen roll). Pilen visar att det sker en kemisk reaktion. På detta sätt blir det genast mycket tydligare och betydligt mer lättöverskådligt. Vi ser vad vi hade från början och vad vi har efter reaktionen.
Oftast använder man inte ord när man skriver en reaktionsformel utan i stället ämnenas summaformler (läs mer om sådana under Formler och modeller). Vätgas skrivs som bekant som H2, syrgas som O2 och vatten som H2O. Reaktionsformeln kan alltså skrivas om till
\( \mathrm{H_2 + O_2 \not\longrightarrow H_2O\,.}\)
Strecket över reaktionspilen visar dock att formeln inte riktigt är färdig. Som vi tidigare har konstaterat försvinner eller nybildas inga atomer vid en kemisk reaktion. Men om vi tittar närmare på vår formel ser vi att det inte alls är lika många atomer på båda sidor om pilen – till vänster har vi två syreatomer medan vi till höger bara har en. Som det ser ut nu verkar en syreatom har försvunnit någonstans på vägen, vilket förstås inte kan vara fallet.
För att en reaktionsformel ska ge en korrekt bild av vad som händer vid reaktionen måste man ibland balansera den. Det gör man genom att sätta ut så kallade koefficienter framför reaktanter och/eller produkter. En koefficient är som en faktor i matematiken och innebär att man gör en multiplikation. I vår formel behöver vi ha dubbelt så många vattenmolekyler på höger sida för att antalet syreatomer ska rätt. Därför använder vi koefficienten 2 och skriver 2H2O, vilket betyder ungefär ”2×H2O”. Eftersom varje vattenmolekyl innehåller två väteatomer och en syreatom, motsvarar 2H2O fyra väteatomer och två syreatomer totalt.
Skriver vi in det i formeln blir det
\( \mathrm{H_2 + O_2 \not\longrightarrow 2H_2O\,.}\)
Nu stämmer antalet syreatomer – två till vänster och två till höger. Men nu antalet väteatomer fel – för att formeln ska stämma behöver vi dubblera antalet vätgasmolekyler till vänster, än en gång med hjälp av koefficienten 2. 2H2 alltså. På så vis får vi fyra väteatomer till vänster och fyra till höger.
\( \mathrm{2H_2 + O_2 \not\longrightarrow 2H_2O\,.}\)
Sådär, nu stämmer vår reaktionsformel. Räknar vi efter har vi fyra väteatomer och två syreatomer till vänster och lika många till höger. Alltså kan vi plocka bort strecket över reaktionspilen, så att vi får
\( \mathrm{2H_2 + O_2 \longrightarrow 2H_2O\,.}\)
I vår formel visar vi att det för varje syrgasmolekyl går åt två vätgasmolekyler. Vi ser också att vi med hjälp av en syrgasmolekyl kan bilda två vattenmolekyler. Denna typ av samband som man kan läsa ut ur en reaktionsformel har kemister stor nytta av i sitt arbete, även om det är lite överkurs för högstadiet.
I följande figur visas vad de olika delarna av en reaktionsformel kallas.
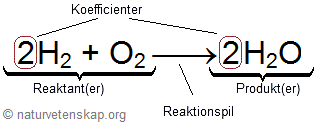
Märk väl skillnaden mellan en koefficient och en indexsiffra. Koefficienten anger antalet molekyler (eller atomer) medan en indexsiffra visar att atomerna sitter ihop. Det är med andra ord stor skillnad på H2 och 2H. När du balanserar en reaktionsformel blir det alltså helt fel om du börjar ändra indexsiffrorna.
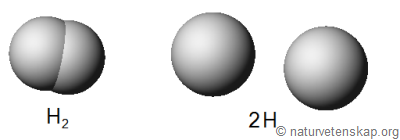
Övningsuppgifter
Med följande uppgifter kan du testa dina kunskaper om reaktionsformler. Vissa av frågorna är ganska svåra, men det viktigaste är inte att du klarar frågan utan att du efter att ha läst svaret förstår principen.
När etanol brinner reagerar det med syrgas och bildar koldioxid och vatten. Skriv en reaktionsformel där du använder ord (och alltså inte summaformler).
Etanol + Syrgas \( \longrightarrow \) Koldioxid + Vatten
Utgå från reaktionsformeln för vätgasexplosionen (\( \mathrm{2H_2 + O_2 \longrightarrow 2H_2O}\)) och förklara hur många vattenmolekyler som kan bildas av följande:
a) Tre syrgasmolekyler
b) 1 229 syrgasmolekyler
c) Fyra vätgasmolekyler
a) För varje syrgasmolekyl som går åt bildas det dubbelt så många vattenmolekyler. Alltså motsvarar tre syrgasmolekyler sex vattenmolekyler.
b) Här gäller samma princip. 1229 syrgasmolekyler motsvaras av dubbelt så många, dvs. 2 458 stycken, vattenmolekyler.
c) Om vi tittar i formeln ser vi att två vätgasmolekyler bildar två vattenmolekyler. Det bildas med andra ord lika många vattenmolekyler som det går åt vätgasmolekyler. Rätt svar är alltså fyra vattenmolekyler.
När en bulldeg jäser bryter jästsvampar ner socker (C6H12O6) i degen till etanol (C2H6O) och koldioxid (CO2). Vilken av nedanstående reaktionsformler beskriver reaktionen korrekt?
\( \mathrm{a) C_6H_{12}O_6 \longrightarrow 3CH_4 + 3CO_2\,.}\)
\( \mathrm{b) 2CO_2 + 2C_2H_6O \longrightarrow C_6H_{12}O_6 \,.}\)
\( \mathrm{c) C_6H_{12}O_6 \longrightarrow 2CO_2 + 2C_2H_6O\,.}\)
\( \mathrm{d) N_2 + 3H_2 \longrightarrow 2NH_3\,.}\)
\( \mathrm{a) C_6H_{12}O_6 \longrightarrow 3CH_4 + 3CO_2\,.}\)
\( \mathrm{b) 2CO_2 + 2C_2H_6O \longrightarrow C_6H_{12}O_6 \,.}\)
\( \mathrm{c) C_6H_{12}O_6 \longrightarrow 2CO_2 + 2C_2H_6O\,.}\)
\( \mathrm{d) N_2 + 3H_2 \longrightarrow 2NH_3\,.}\)
Reaktion a kan vi direkt utesluta. Även om den är helt riktigt balanserad visar den inte den reaktion vi söker, utan i stället en annan form av nedbrytning av socker där gasen metan (CH4) och koldioxid bildas.
Reaktion b då? Här är i alla fall rätt ämnen inblandade, men trots det är det inte rätt svar. Reaktionen går nämligen åt fel håll! I stället för att socker bryts ner till etanol och koldioxid, bildas det socker.
Då återstår bara två alternativ, av vilka d direkt kan uteslutas. Det beskriver ju en helt annan reaktion (bildningen av gasen ammoniak) som inget av våra ämnen är med i.
Kvar blir reaktion c, där både reaktanter, produkter och balanseringar stämmer. Rätt svar är alltså c.
Kol (C) och vätgas (H2) kan reagera och bilda metan (CH4). Försök ta fram en balanserad reaktionsformel för reaktionen.
Vi börjar med att beskriva reaktionen med en ordformel:
Kol + Vätgas \( \longrightarrow\) Metan.
Sen ersätter vi orden med kemiska tecken och får
\( \mathrm{C + H_2 \not\longrightarrow\: CH_4\,.}\)
Räknar vi efter ser vi att vi har en kolatom och två väteatomer till vänster. På höger sida är det också en kolatom, men fyra väteatomer. Reaktionsformeln är alltså inte helt balanserad ännu (därför sätter vi ett streck över pilen). Tänker vi efter en stund märker vi att vi måste dubblera antalet vätgasmolekyler på vänster sida. Detta gör vi med koefficienten 2. Vi skriver alltså
\( \mathrm{C + 2H_2 \longrightarrow\: CH_4\,.}\)
Om vi kontrollräknar ser vi att vi nu har lika många atomer av de olika atomslagen på båda sidor; en kolatom och fyra väteatomer till vänster och lika många till höger,
\(\mathrm{\underbrace{\:\:\:C\:\:\:}_{1\,C-atom} + \underbrace{2H_2}_{2\times 2=4\,H-atomer} \longrightarrow \underbrace{CH_4}_{1\,C-atom, 4\,H-atomer}}\)