Une analyse de sang (ou prise de sang) est une procédure médicale courante utilisée pour analyser la composition du sang d’un patient.
L’infirmier(e) doit être vigilant(e) lorsqu’il/elle prélève des échantillons de sang afin de garantir la sécurité du patient. Une mauvaise technique peut entraîner des résultats inexacts, des séjours prolongés à l’hôpital, des diagnostics tardifs et des traitements inutiles.1
Erreur de prescription, défaut d’identitovigilance, tube mal rempli… 60 à 75 % des erreurs en biologie surviennent en phase pré-analytique.2
Ce guide pratique du prélèvement de sang veineux à l’intention des étudiant(e)s et/ou infirmier(e)s explique le déroulement du soin pas à pas conformément aux bonnes pratiques ainsi que des conseils pratiques pour garantir la sécurité et le confort du patient.
Si vous souhaitez connaître les prérequis du prélèvement veineux, nous avons publié un autre article qui couvre les aspects essentiels à prendre en compte pour un prélèvement sanguin réussi. Cela comprend la législation, les indications, les contre-indications, le matériel, les informations cliniques pertinentes et les complications possibles. Vous pouvez accéder à cet article détaillé en cliquant sur le lien suivant : Prélèvement sanguin : les prérequis essentiels pour un soin réussi
Préparation du prélèvement sanguin veineux : comment assurer la sécurité et le confort du patient
Après avoir soigneusement examiné la prescription et le dossier du patient, et rassemblé le matériel nécessaire, vous êtes prêt à procéder au prélèvement sanguin. Une fois à proximité de votre patient, vous pouvez commencer à :
Assurer l’identitovigilance3
Le patient doit donner son nom, son prénom et sa date de naissance. La question doit être ouverte. Évitez « Votre nom est bien Dupont ? », car une personne avec des troubles cognitifs ou malentendante pourra répondre oui bien que ce ne soit pas son nom.
Recueillir le consentement du patient
- Expliquer pourquoi on effectue le prélèvement.
- Définir les différentes étapes.
- Rassurer le patient.
- Répondre à ses questions.3
Il est également préférable de prendre connaissance des antécédents du patient avant le soin. A-t-il déjà fait un malaise, eu des complications… ? A-t-il des allergies ?
Vérifier les données pré-analytiques
Respecter le jeûne, récolter les informations4…
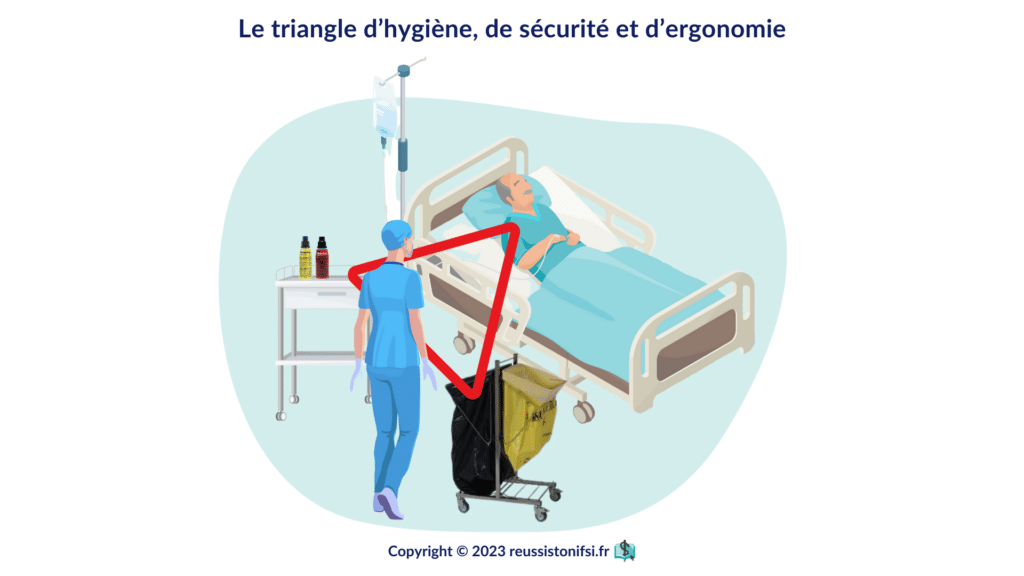
Préparer l’environnement
Respecter le triangle (ergonomie, sécurité et hygiène), s’installer soi-même et installer le patient correctement.3
Nettoyer le plan de travail3
Nettoyer le plan de travail avec le produit adéquat.
Prévenir la douleur
Pour prévenir la douleur, il est important de fournir des informations, s’assurer de la présence des parents si on prélève un patient mineur, utiliser un équipement approprié, s’assurer de l’habileté et de la dextérité du soignant, utiliser une crème anesthésiante ou du MEOPA sur prescription médicale ou protocole, et employer des techniques de distraction.5 Si vous souhaitez approfondir ce sujet, nous avons publié un article en lien : Comment réduire la douleur et l’anxiété des patients lors des soins
Préparer la zone de prélèvement
Dégager la zone, c’est-à-dire le pull, le tee-shirt, par exemple, et bien faire positionner le bras.3
Comment identifier la veine appropriée pour un prélèvement sanguin veineux efficace
Utilisation correcte du garrot
Le garrot doit s’appliquer à proximité du site de prélèvement (environ la largeur d’une main).3 Le garrot doit être utilisé pour identifier la veine, cependant, il ne doit pas rester en place pendant le prélèvement sanguin sauf si la veine est petite et difficile d’accès. Dans ce cas, il doit être serré modérément. Le pouls radial doit être palpable.5.6
Si vous laissez le garrot trop longtemps en place, les cellules « explosent », ce qui causera une hémolyse et/ou une hyperkaliémie, car il y a du potassium dans les globules. Ne pas le laisser en place plus d’une minute.6.7
Pour certains tests, le garrot ne doit pas être utilisé. Veuillez vous référer au protocole du laboratoire pour plus de détails.5.6
Techniques pour repérer la veine
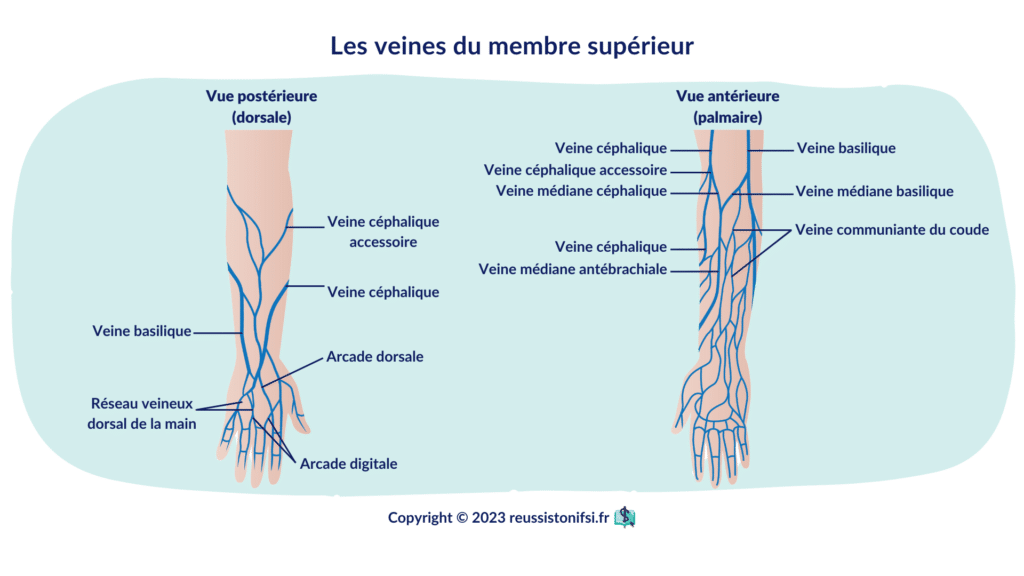
Pour identifier une veine adéquate, large, visible et palpable, plusieurs options sont disponibles. La veine cubitale médiane, qui se situe entre les muscles, est généralement la plus accessible pour une ponction. La veine basilique, quant à elle, se trouve sous une artère et un nerf, donc une ponction à cet endroit peut causer de la douleur ou endommager le nerf ou l’artère. Il est recommandé d’éviter de piquer là où les veines se divisent, car cela peut augmenter le risque de formation d’un hématome.7
Commencez par effectuer une inspection préliminaire non stérile pour identifier une veine appropriée.8 Utilisez votre index pour palper la zone et localiser une veine. Il est préférable de choisir une veine que vous pouvez sentir plutôt qu’une veine que vous pouvez voir.
Enfin, laissez le bras du patient pendre afin d’augmenter la pression veineuse. Cela peut aider à rendre les veines plus visibles et plus faciles à ponctionner.
Retirer le garrot et appliquer un anesthésique si nécessaire.
Laissez suffisamment de temps à l’anesthésique pour agir (par exemple, 1 à 2 minutes pour du MEOPA, 30 minutes pour un produit topique).
Conseils
Pour les individus en surpoids, il peut être plus aisé d’effectuer un prélèvement sur les veines situées au dos de la main.
Si aucune veine n’est identifiable, il est également possible de recourir aux veines des membres inférieurs pour le prélèvement.8
Dans le cas où une veine adéquate n’est pas aisément visible ou palpable, l’utilisation d’un dispositif de détection de veines peut s’avérer utile.
Comprendre l’ordre correct des tubes pour un prélèvement sanguin veineux
L’ordre de prélèvement des tubes est assez simple à retenir grâce à une astuce mnémotechnique. Vous pouvez les prélever en suivant l’ordre alphabétique, à l’exception du tube gris qui est généralement utilisé en dernier et moins fréquemment : Bleu, Jaune, Rouge, Vert, Violet, (et finalement Gris).3
Attention, la correspondance entre la couleur du tube et l’examen à réaliser peut varier d’un laboratoire à l’autre, car tous n’utilisent pas les mêmes codes couleur.
Il est donc recommandé de se référer à une fiche pratique disponible dans l’établissement où vous travaillez pour assurer une correspondance précise.

Spécificité de chaque tube de prélèvement
Les hémocultures : utilisation et spécificités
Les hémocultures consistent en la collecte et la culture d’échantillons de sang dans un environnement spécifiquement conçu pour favoriser la croissance des bactéries. L’objectif principal de cette procédure est de détecter la présence de bactéries dans le sang, de les identifier précisément et d’évaluer l’efficacité et la spécificité des antibiotiques en utilisant une technique appelée antibiogramme.
Il existe deux types de flacons utilisés pour les hémocultures, chacun adapté à un type spécifique de bactéries :
- Les flacons aérobies : ces flacons sont utilisés pour la culture de bactéries aérobies, qui nécessitent de l’oxygène pour leur croissance et leur survie.
- Les flacons anaérobies : ces flacons sont destinés à la culture de bactéries anaérobies, qui peuvent se développer en l’absence d’oxygène.
Le tube bleu citraté : utilisation et spécificités
Le tube citraté (tube bleu) tient son nom du citrate de sodium qu’il contient. Il est toujours prélevé en premier, pour éviter que l’héparine du tube vert contamine le tube citraté. Il est utilisé pour les bilans de coagulation et le suivi d’un traitement par anticoagulant.
Exemples d’examens possibles : TP, TCA, Fib, D-dimères, Héparinémie / Anti Xa, Facteur V…
Le tube sec jaune avec gel : utilisation et spécificités
Ce tube ne contient aucun anticoagulant, le sang va donc pouvoir coaguler dans le tube (effet recherché). Après centrifugation, le gel fait interface entre la partie liquide et les cellules, et empêche ainsi que les deux se re-mélangent.
Exemples d’examens possibles : AcHBs, ACE, Acide urique, AFP, ALAT, Albumine, Amylase, ASAT, Bilirubine T, CA 125, Calcium, Chlore, Cholestérol T, CPK, Créatinine, CRP, Ferritine, FSH, GGT, Insuline, LDH, LH, Magnésium, PSA, Triglycérides, TSH, Urée, Vit B12, Vit D…
Le tube sec rouge : utilisation et spécificités
Ce tube ne contient aucun anticoagulant, le sang va donc pouvoir coaguler dans le tube (effet recherché). Il contient seulement un activateur de la coagulation (microparticules de silice). Après centrifugation, nous obtiendrons donc du sérum.
Exemples d’examens possibles : Procalcitonine, LYME, HELISER, ACTRA, TRAK, ASDOR, MNI, WR, HSV, SCH, VZV, ACAN, ACDNA, ECT, ACTIS, ANCA, ACENDG, ACCARD , B2GP…
Le tube vert hépariné : utilisation et spécificités
Le tube hépariné (tube vert) tient son nom de l’héparine de lithium qu’il contient. Il permet d’effectuer l’ionogramme. L’héparine empêche le sang de coaguler sans apporter d’ions qui fausseraient les résultats de l’ionogramme.
Exemples d’examens possibles : Chlore, Ionogramme, Potassium, Sodium, Troponine…
Le tube violet EDTA : utilisation et spécificités
Le tube EDTA (tube violet) tient son nom de l’Éthylène Diamine Tétra-Acétique qu’il contient. Il est utilisé pour les numérations (globules blancs, globules rouges, plaquettes), l’hémoglobine glyquée, les déterminations du groupe sanguin, les RAI…
Exemples d’examens possibles : NFS, Plaquettes, VS, Réticulocytes, Kleihauer, Paludisme, Groupe sanguin, Rhésus, Phénotype, Agglutinines Irrégulières, BNP, HbA1c, Electro de l’hémo- globine (+ NFS) …
Le tube gris fluorure : utilisation et spécificités
Le tube fluorure (tube gris) tient son nom du fluorure de sodium et l’oxalate de potassium qu’il contient. Ce tube est utilisé pour le dosage de la glycémie.
Exemples d’examens possibles : Glycémie (à jeun, postprandiale, après charge), Cycle glycémique, HGPO…
Guide étape par étape pour le prélèvement sanguin veineux
Préparation du matériel
Il est nécessaire de fixer l’aiguille ou l’unité à ailette sur le corps de pompe et de disposer les tubes dans l’ordre sur le plateau. Tout doit être préparé et prêt à l’utilisation.3
Importance du respect de l’hygiène
Il est crucial de se laver les mains avec une solution hydroalcoolique de manière appropriée, par exemple avant et après avoir mis des gants à usage unique, et lors de l’entrée et de la sortie de la chambre du patient. La zone de prélèvement doit être désinfectée en tenant compte des allergies du patient et du protocole de l’établissement.1 Plusieurs antiseptiques peuvent être utilisés à cet effet. Selon la Société Française d’Hygiène Hospitalière, il n’y a pas d’études confirmant la nécessité de désinfecter la zone de prélèvement. Cependant, l’OMS recommande l’utilisation de l’alcool pour les prélèvements sanguins afin de minimiser le risque de contamination du sang.1.9
Une fois la désinfection effectuée, il est important de suivre les instructions spécifiques au produit utilisé, en veillant à laisser la zone sécher complètement, ce qui prend environ 30 secondes.
Après la désinfection, évitez de toucher la zone. De plus, ne prélevez pas de sang d’une zone encore humide d’alcool.1.6
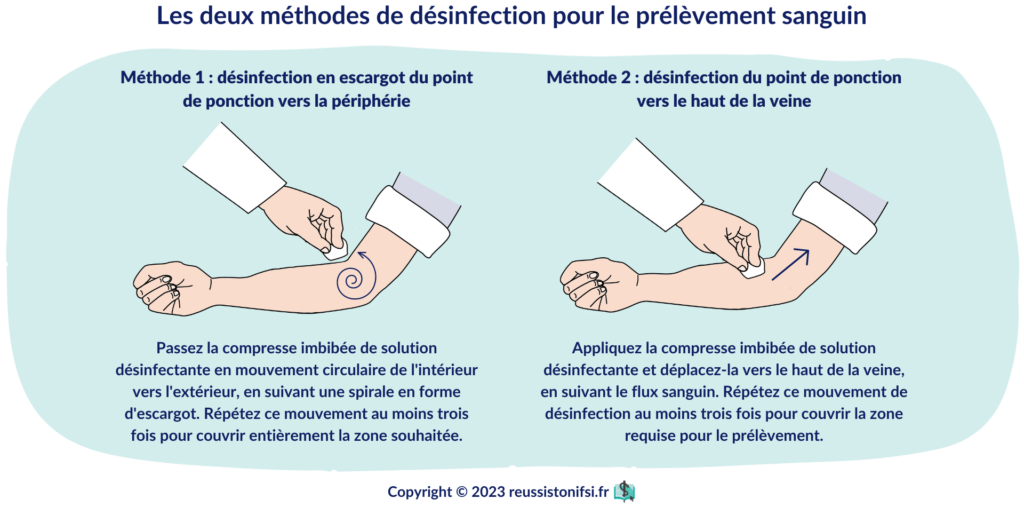
Pour le nettoyage, utilisez une technique en spirale, en partant du centre vers la périphérie, ou de l’endroit qui sera ponctionné vers le haut de la veine. Effectuez trois passages successifs et respectez le temps de séchage.5.6
Réapplication correcte du garrot
Replacez le garrot en amont du site d’insertion choisi. Ensuite, mettez des gants à usage unique.1 Il est important de ne pas demander aux patients de serrer le poing ou de laisser le bras pendre pendant le prélèvement sanguin.6.8 Enfin, assurez-vous de bien tendre la peau.
Comment prévenir le patient avant le prélèvement sanguin
Informez le patient de manière apaisante. Évitez des phrases stressantes comme « Attention, je pique ! » et optez plutôt pour des instructions plus rassurantes comme « Respirez, j’y vais. » Nous avons publié un article que vous pouvez lire ou écouter sur ce sujet : Comment réduire la douleur et l’anxiété des patients lors des soins
Technique pour insérer l’aiguille lors du prélèvement sanguin
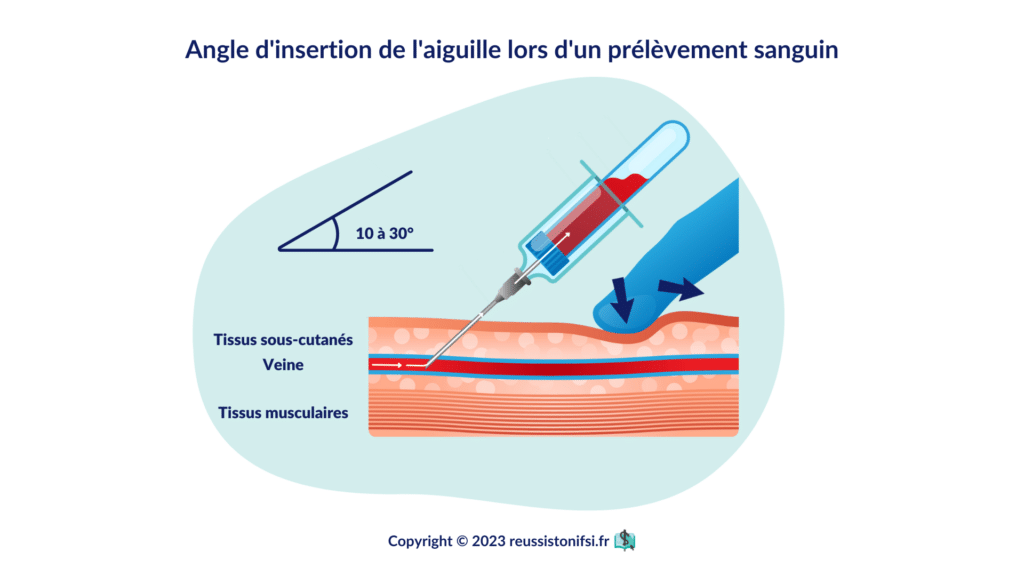
Procédez à l’insertion de l’aiguille en suivant le sens du flux sanguin veineux, avec le biseau orienté vers le haut, le long de la ligne médiane de la veine. Assurez-vous que l’angle d’insertion par rapport à la peau est faible, généralement entre 10 et 30 degrés.
Quand cesser d’avancer l’aiguille lors du prélèvement sanguin
Lorsque la pointe de l’aiguille pénètre dans la lumière de la veine8, vous devriez voir apparaître du sang. Si le sang n’est pas visible après une insertion de 1 à 2 cm, retirez l’aiguille doucement. Si le sang n’apparaît toujours pas, retirez l’aiguille presque jusqu’à la surface de la peau, changez de direction et tentez à nouveau de pénétrer la veine avec l’aiguille.
En cas de gonflement local rapide, cela indique une extravasation de sang. Dans ce cas, retirez le garrot et l’aiguille, puis appliquez une pression sur le point de ponction avec une compresse jusqu’à l’arrêt du saignement.
Si vous utilisez des tubes à vide, assurez-vous de pousser chaque tube à fond dans le porte-tube, tout en veillant à ne pas éloigner l’aiguille de la veine.8
Retirer le garrot lorsque le sang commence à s’écouler
Il est important de retirer le garrot afin de ne pas dépasser la durée d’une minute.10 Assurez-vous de bien maintenir l’aiguille et le corps de la pompe pour éviter qu’ils ne sortent de la veine. Ensuite, insérez les tubes dans l’ordre spécifié (plus de détails sont disponibles plus loin dans l’article).5.6
Comment homogénéiser les tubes après le prélèvement sanguin
Il est essentiel de mélanger chaque tube en réalisant des mouvements amples, délicats et réguliers. Il convient d’éviter de transférer le sang entre les tubes.6.4 Quel que soit le dispositif utilisé, la coagulation du sang prélevé commence immédiatement, avec l’apparition de micro-caillots dans les 15 premières secondes. Il est crucial de ne pas secouer les tubes de manière excessive.10.11
| Additif ajouté au tube | Nombre de retournements |
| Activateur de coagulation | 5 |
| Citrate de sodium | 3 à 4 |
| Autres anticoagulants | 8 à 10 |
Procédures post-prélèvement sanguin veineux
Retirer correctement l’aiguille après le prélèvement sanguin
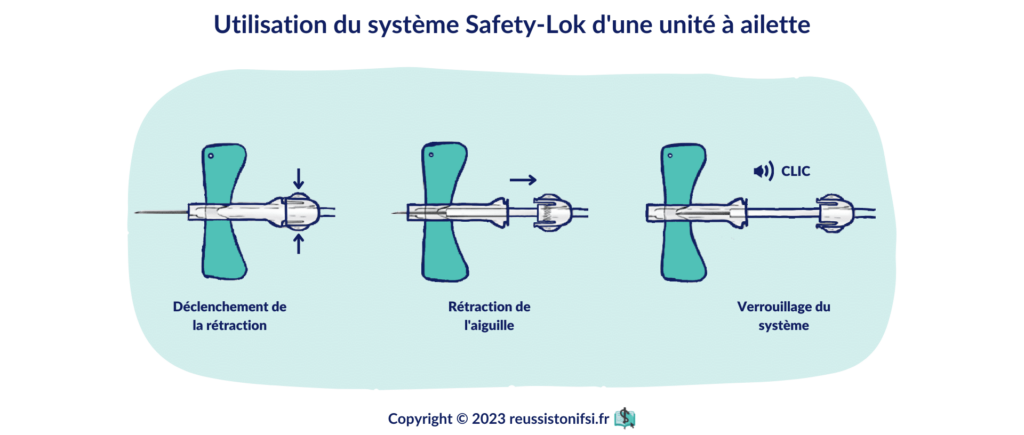
Utilisez une compresse pour retirer l’aiguille de prélèvement et vérifiez que le garrot est complètement relâché.5 Si vous utilisez un dispositif à ailettes, voici la procédure à suivre :
Gérer les déchets
Tous les déchets contaminés par le sang doivent être éliminés dans les conteneurs DASRI, tandis que l’aiguille doit être déposée dans le collecteur OPCT. Il est important de ne pas désassembler l’aiguille avant de la jeter. Évitez de manipuler une aiguille séparée du corps à mains nues. Utilisez une pince à clamper ou jetez l’ensemble dans le collecteur OPCT.1 Les autres déchets peuvent être jetés dans les poubelles DAOM. Le matériel légèrement imbibé de sang peut également être éliminé dans les DAOM.9 Pour plus d’informations, n’hésitez pas à consulter le cours de l’UE 2.10 S1 sur la gestion des déchets disponible sur notre plateforme de révisions.
Comprimer le point de ponction
Appliquez une pression sur la zone pendant quelques minutes5, puis remplacez le tampon d’alcool par une compresse sèche. Informez le patient qu’il pourra retirer le pansement ultérieurement.5 Assurez-vous que l’hémostase est complète avant de quitter le patient.5 Évitez de masser le point de ponction, car cela pourrait entraîner des saignements.5 Le choix du pansement doit être fait en fonction du type de peau du patient et de ses éventuelles allergies.5
Procédures à suivre avant de quitter la pièce post-prélèvement sanguin
Si nécessaire, assistez le patient pour se rhabiller et se réinstaller confortablement. Assurez-vous d’étiqueter chaque tube correctement.
- Pour les enfants : apportez-leur du réconfort, félicitez-les et envisagez de leur remettre un « diplôme de bravoure »5.
- Pour les adultes : remerciez-les pour leur coopération.5
- Pour les adultes, les enfants et les parents : n’hésitez pas à leur demander s’ils ont d’autres questions et vérifiez s’ils ont bien compris les conseils donnés. Ensuite, rangez et nettoyez le matériel et désinfectez-vous les mains.
Avant d’apposer les étiquettes sur les tubes en présence du patient, vérifiez une dernière fois la cohérence de tous les documents, étiquettes et informations relatives au patient.5 Les tubes qui seront envoyés au laboratoire médical doivent être correctement identifiés avec le nom de naissance, le nom marital ou usuel, le prénom et la date de naissance du patient.
N’oubliez pas de noter l’heure de prélèvement sur le document qui sera envoyé au laboratoire.
Traçabilité : une étape cruciale après le prélèvement sanguin
Pour assurer une traçabilité optimale, chaque soin administré doit être écrit dans le dossier du patient. Il est nécessaire de marquer le soin comme administré et de rédiger des transmissions détaillées.
Que faire après un prélèvement sanguin veineux :
conseils et recommandations
Délai et transport
Le temps recommandé pour acheminer les échantillons au laboratoire, essentiel pour maintenir l’intégrité de l’échantillon, peut varier en fonction du type de test à réaliser. Idéalement, il est préférable de livrer les échantillons au laboratoire le plus rapidement possible. Il est impératif de respecter scrupuleusement les délais indiqués en rouge. Ces délais s’étendent généralement de 4 à 8 heures maximum.4
| Type de tubes | Délai et T°C |
| Tube citrate | 8h à 18h à 22°C < + 4°C interdit |
| Tube héparine | 4h à 18-22°C |
| Tubes sérum | 8h à 18-22°C |
| Tube fluoré | 8h à 18-22°C |
| Tube EDTA | 8h à 18-22°C |
La non-conformité après le prélèvement sanguin
La non-conformité est la « non-satisfaction d’une exigence (écart constaté par rapport aux procédures, rédigées pour répondre à la norme) ».12
Les motifs de rejet d’un échantillon peuvent être regroupés en trois catégories principales4.11 :
- Critères administratifs :
Ces problèmes sont généralement liés à l’identification du patient, comme des erreurs, des omissions ou des incertitudes. Ils peuvent également concerner des formulaires d’échantillonnage incomplets, qui manquent d’informations essentielles telles que le nom de la personne qui a prélevé l’échantillon, l’heure du prélèvement, les informations thérapeutiques, etc. - Critères qualitatifs :
Ces problèmes sont liés au non-respect des délais ou des températures requises, comme des tubes fondus ou des délais trop longs. Ils peuvent également concerner l’utilisation d’un tube inadapté pour l’analyse ou le non-respect des recommandations pré-analytiques, comme le jeûne ou l’heure du prélèvement. - Critères quantitatifs :
Ces problèmes sont liés à des tubes mal remplis, comme des tubes citratés, ou à un nombre insuffisant de tubes, comme des tubes EDTA pour une numération formule sanguine, une hémoglobine glyquée, un groupe sanguin, etc.
Pourquoi est-il important de bien remplir les tubes lors du prélèvement sanguin ?
Il est crucial de remplir le tube citraté jusqu’à la marque indiquée, car il contient un volume spécifique d’anticoagulant. Les résultats attendus sont basés sur cette dilution précise. Si le sang est sur-dilué ou sous-dilué, cela pourrait conduire à des résultats faussement normaux ou anormaux.
Transvaser du sang d’un tube vert à un tube bleu introduit un autre anticoagulant qui pourrait perturber les réactions chimiques et fausser les résultats. De même, si du sang est transvasé d’un tube violet à un tube vert, cela pourrait entraîner une augmentation artificielle du potassium et une diminution artificielle du calcium. Parfois, même le simple fait de prélever le sang dans un tube violet avant un tube vert peut entraîner le transfert d’une goutte d’EDTA dans le tube vert, faussant ainsi les résultats.
Si le prélèvement sanguin est difficile sur un patient, il est préférable d’utiliser un tube pédiatrique et de le remplir à moitié, car il contient moitié moins d’anticoagulant. Il est déconseillé de transvaser du sang d’un tube bleu adulte mal rempli dans un tube pédiatrique, car cela pourrait également fausser les résultats.
Nous sommes reconnaissants envers Marouan Bennani biologiste médical, pour la relecture de cet article et ses précieux conseils.
Sources
- Organisation mondiale de la Santé. « Lignes directrices de l’OMS applicables aux prélèvements sanguins : meilleures pratiques en phlébotomie » – 2010
- Lippi G, Chance JJ, Church S, Dazzi P, Fontana R, Giavarina D, et al. « Preanalytical quality improvement: from dream to reality » Clin Chem Lab Med 2011;49(7):1113-26.
- Réussis ton IFSI « Prélèvements sanguins » – [Cours appartenant à l’U.E. 4.4, Semestre 2], 2023.
- Aquilab « Guide des prélèvements » – consulté en mai 2023
- Hôpitaux Universitaires de Genève – « Prise de sang veineuse et capillaire chez l’adulte et l’enfant » – 2019/2020
- Hôpitaux universitaires de Genève « PRÉLÈVEMENT SANGUIN PAR PONCTION DIRECTE (SYST. VACUTAINER) » – avril 2017
- Ordre Professionnel des Technologistes Médicaux du Québec « Guide de prélèvement de sang par ponction veineuse aux fins d’analyses » – décembre 2018
- Manuels MSD – « Comment effectuer un prélèvement de sang veineux » par Yiju Teresa Liu , MD, Harbor-UCLA Medical Center – Octobre 2020
- Société Française d’Hygiène Hospitalière « Antisepsie de la peau saine avant un geste invasif chez l’adulte. Recommandations pour la pratique clinique » – Mai 2016
- Santé publique du Canada « Pratiques de base et précautions additionnelles visant à prévenir la transmission des infections dans les milieux de soins » – Modifié en 2017
- CHU Dijon – « Examens de Biologie Médicale et Prélèvements sanguins. Notions fondamentales et Rappels » 19 02 2020 Dr Nathalie SIXT, Biologiste
- Conseil, Audit et Accompagnement. « Les constats d’audit et remarques d’audit » – mai 2017