Nerven brauchen Raum, Bewegung und Blut (AIGS) Teil 2
Ihr erinnert euch vielleicht noch an unseren Beitrag über die Pathophysiologie der AIGS?
Leider fehlt es bis dato an evidenzbasierten therapeutischen Strategien, um AIGS bzw. deren Folgen zu reduzieren. Allerdings kann sich hier ein Blick auf Grundlagenstudien im Bereich neuropathischer bzw. radikulärer Schmerzen lohnen.
Diese Erkenntnisse aus den Grundlagenstudien und die sich daraus ergebenden therapeutischen Konsequenzen wollen wir in diesem Beitrag genauer beleuchten.
Viel Spaß dabei!
1. NERVEN BRAUCHEN RAUM
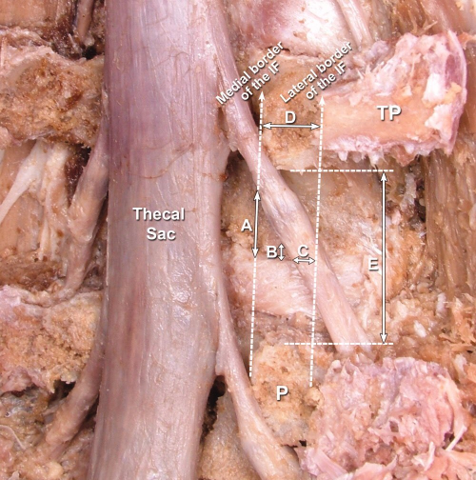
Empfindliche Nerven, das Rückenmark und die Hirnhäute (Meningen) „reisen“ alle in Containern bzw. Verbindungswegen durch den Körper. Damit die Nerven richtig funktionieren, müssen sie in der Lage sein, ungehindert durch verschiedene Körperregionen zu „gleiten” und zu „rutschen“.1,2,3 Auf ihrem Weg durch den Körper treffen sie auf viele umgebende Gewebe wie Muskeln, Knochen, Bänder und Faszien.1,2,3,4
Zahlreiche Studien konnten gezeigt, dass eine Veränderung dieser Schnittstellen (Interfaces, durch Verletzung oder Krankheit) Auswirkungen auf das angrenzende Neuralgewebe haben kann.10, 38-46
2. NERVEN BRAUCHEN BEWEGUNG
Eng verbunden mit der obigen Diskussion über den Platzbedarf des Nervensystems ist seine Fähigkeit, komplexe Signalprozesse während physiologischer Bewegungen durchzuführen. Unter normalen Bedingungen bewegen sich die Nerven recht gut.2,9-15
Von der neutralen Position der Halswirbelsäule bis hin zur Flexion der HWS verlängert sich das Rückenmark um etwa 10 Prozent, während die Länge des Halsmarks aus der HWS-Streckung bis zur HWS-Beugung um ca. 20 Prozent zunimmt.16
Zudem ist ebenfalls dokumentiert, dass sich der Spinalkanal (der „Container) um ca. 30 Prozent von der Wirbelsäulenextension bis zur –flexion verlängert.17
Das periphere Nervensystem muss in der Lage sein, sich an Bewegung anzupassen; so hat die Forschung beispielsweise gezeigt, dass sich der N. medianus von der Position der Handgelenks- und Ellbogenflexion bis zur Position der Handgelenks- und Ellenbogenextension an ein Nervenbett anpassen muss, das fast 20% länger wird.18
Wenn wir unsere Hand in die Luft strecken und winken, müssen sich die Nerven in Arm und Nacken bewegen, damit wir dazu überhaupt in der Lage sind.7
Aktualisierte Ergebnisse unter Verwendung von Feindrahtsensoren9 und diagnostischem Ultraschall10,11,19-22 dokumentieren eindeutig die Bewegungsmöglichkeiten des Nervensystems.
3. NERVEN BRAUCHEN BLUT
Neurales Gewebe ist extrem “blutdürstig”. Das Gehirn und das Rückenmark machen schätzungsweise nur zwei Prozent der Gesamtkörpermasse aus, verbrauchen aber 20-25% des verfügbaren Sauerstoffs im zirkulierenden Blut.23 Zudem hat sich gezeigt, dass bei einer Verlängerung des peripheren Nerven um mehr als sechs bis acht Prozent der Blutfluss im Nerv selbst verlangsamt wird. 24,25
Wenn der Nerv dagegen um etwa 15% gedehnt wird, kann der Blutfluss vollständig zum Erliegen kommen.25
Was können wir aus Grundlagenstudien lernen?
Veränderte neurodynamische Tests werden als Mittel zum Nachweis eines sensibilisierten Nervensystems gesehen.
Wenn ein positiver neurodynamischer Test mit einer erhöhten Sensibilisierung assoziiert ist, lässt sich argumentieren, dass eine normalisierte Neurodynamik eine verminderte Sensibilisierung anzeigen kann.26,27,28
Es gibt Hinweise darauf, dass neurodynamische Tests verschiedene endogene Mechanismen verstärken können.29-32
Neurodynamische Behandlungen verbessern nachweislich die Druckschmerzschwellen, erhöhen die Beweglichkeit und verringern die Schmerzen 33-37,47,48
Um die Unabhängigkeit und Selbstwirksamkeit zu fördern, sollten sich Therapeuten vor allem auf aktive anstatt passive neurodynamische Behandlungen konzentrieren.38 Zudem scheinen bei einem sensibilisierten Nervensystem initial sanftere Techniken („Sliders”) vorteilhafter als aggressivere Techniken („Tensioners”) zu sein, um die Sensitivität nicht weiter zu erhöhen und keine latenten Schmerzerfahrungen zu verursachen.4
Was können wir aus Grundlagenstudien für die Behandlung radikulärer Schmerzen lernen?
Die meisten untersuchten Interventionen basieren noch auf dem „konventionellen“ PT Denkmodell und zeigen – wenn überhaupt – eher geringe Effekte.36
Allerdings findet sich gute Evidenz in präklinischen Studien, dass Training hypoalgetisch, neuroprotektiv und neuroregenerativ wirken kann.76-78 (s. Anhang „Wirkmechanismen“)
- Aerobes Training und neurodynamische Behandlungen zeigen hier bis dato die größten Effekte.
Die Intensität des aeroben Trainings sollte jedoch niedrig bis moderat sein, um seine positiven Effekte entfalten zu können. Zu intensives Training könnte neurotoxisch wirken.79,80 Des Weiteren scheint das Timing des Trainings wichtig zu sein. Bei Tieren ist ein Training eine Woche nach Nervenverletzung sicher und führt zu besseren Ergebnissen als ein späterer Trainingsbeginn.81
Neurodynamische Mobilisation werden in Tierstudien deutlich aggressiver durchgeführt als in der klinischen Praxis (z.B. Slider). Hier gilt es zu untersuchen, ob eine aggressivere Mobilisation auch am Menschen erfolgsversprechend ist.
Sollten wir Patienten gezielter auswählen?
Wenn wir davon ausgehen, dass unterschiedliche Pathomechanismen bestehen, könnte es sein, dass einige Patienten schlechtere Resultate durch eine suboptimale Behandlung erzielen.
Dahingehend wurde ein Ansatz des „sensory phenotyping“ entwickelt. So kann man momentan drei Phänotypen über verschiedene neuropathische Schmerzerkrankungen hinweg zuordnen. Diese Typen sind:50
- „sensorischer Verlust“,
- „Hyperalgesie“ und
- „mechanische Hyperalgesie“
Eine plausible Hypothese wäre beispielsweise Folgende: Radikuläre Schmerzen, die durch einen „sensorischen Verlust“ gekennzeichnet sind, sollten besser mit aeroben Training behandelt werden, da dieses die axonale Regeneration stimuliert.
Im Gegensatz dazu würden Patienten mit „mechanischer Hyperalgesie“ (assoziiert mit zentralen Mechanismen) eher auf ein gezielteres neurodynamisches Management ansprechen. 48,51
Anhang: Wirkmechanismen in präklinischen Studien
Erklärungs-“Nuggets“ für Patienten mit neuropathischen Beschwerden7,8…
Erklärungskonzepte, die man betonen sollte…7,8
Nerven:
- „…sind dick und robust, mit einer Umhüllung als Schutz.“
- „…sollten mit dem restlichen Körper bewegt, gedehnt und mobilisiert werden.“
- „…lieben Bewegung. Ein Training macht sie beweglich, reduziert Entzündungen und liefert frisches Blut.“
„Eingeklemmter Nerv“:
- „Selbst wenn man etwas Raum verliert, gibt es noch genügend Platz.“
- „Nerven sind biegsam und gleitfähig – man kann sie nicht wirklich „einklemmen“. Das wäre so, als wollte man Litschis mit Stäbchen aufheben.“
- „Eher etwas bedrängt oder komprimiert als „eingeklemmt“.
Schmerz vs. Schaden:
- „Ziehen und Stechen bedeuten nicht, dass der Nerv verletzt ist – wahrscheinlich ist er sensibilisiert.“
- „Die meisten schmerzenden Nerven sind empfindlich, aber „sicher“.
- „Wenn der Nerv seine Arbeit nicht wie gewohnt macht, dann kann er sich genauso wie Muskeln und Bänder regenerieren.“
Ungewöhnliche Symptome
- „Nachtschmerz ist normal und kommt durch einen Abfall des Blutdrucks und oft dadurch zustande, dass man in einer ungünstigen Position einschläft.“
- „Empfindliche Nerven senden alles, was sie nur können in Richtung Gehirn – manchmal komische und wundersame Dinge (s. unseren Beitrag zu abnormen impulserzeugenden Stellen, AIGS).“
- „Normalerweise ist in dem Bereich, in dem Sie Schmerzen verspüren, alles in Ordnung.“
Anhang „Wirkmechanismen von körperlichem Training bei der Regeneration von posttraumatischen, peripheren Nervenverletzungen46
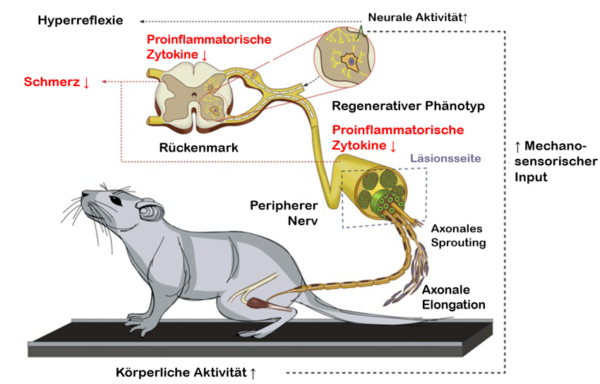
Schematische Darstellung hypothetischer Mechanismen zur Wirkung von körperlicher Bewegung auf Nervenregeneration und funktionelle Regeneration46
- Höhere Aktivität durch Laufbandübungen führt zu mechanosensorischen Inputs, die in das ZNS übergehen und durch Regeneration sensorischer Neurone oder propriospinaler Schaltkreise den Input auf verletzte Motoneuronen erhöhen. Die Aktivierung von absteigenden spinalen Pfaden nimmt ebenfalls während des Laufbandtrainings zu (nicht dargestellt).
- Konvergierende exzitatorische Inputs verbessern die regenerative Reaktion von verletzen Axonen und fördern die Zunahme der Anzahl der auswachsenden Axone in den distalen Nervenstumpf. Eine erhöhte Aktivität innerhalb neuronaler Bahnen stimuliert auch die axonale Verzweigung und erhöht die Rate der axonalen Elongation.
- Laufbandtraining kann das Niveau neurotropher Faktoren im Vorderhorn des Rückenmarks und im regenerierenden Nerv erhöhen. Das Niveau proinflammatorischer Zytokine im Rückenmark und in den verletzten peripheren Nerven wird durch Laufbandübungen vor und nach der Verletzung gesenkt. Dies spiegelt entweder eine geringere neuroinflammatorische Reaktion oder eine schnellere Auflösung dieser Reaktion wider.
- Verminderte Mengen an proinflammatorischen Zytokinen bzw. an pronozizeptiven neurotrophen Faktoren im Hinterhorn des Rückenmarks (z.B. GDNF und NT-3), die aus dem Laufbandtraining resultieren, unterdrücken die Glia-Aktivierung, die Hyperreflexie und verhindern die Entwicklung neuropathischer Schmerzen.
- Laufbandtraining kann das Niveau neurotropher Faktoren im Vorderhorn des Rückenmarks und im regenerierenden Nerv erhöhen. Das Niveau proinflammatorischer Zytokine im Rückenmark und in den verletzten peripheren Nerven wird durch Laufbandübungen vor und nach der Verletzung gesenkt. Dies spiegelt entweder eine geringere neuroinflammatorische Reaktion oder eine schnellere Auflösung dieser Reaktion wider.
- Verminderte Mengen an proinflammatorischen Zytokinen bzw. an pronozizeptiven neurotrophen Faktoren im Hinterhorn des Rückenmarks (z.B. GDNF und NT-3), die aus dem Laufbandtraining resultieren, unterdrücken die Glia-Aktivierung, die Hyperreflexie und verhindern die Entwicklung neuropathischer Schmerzen.
Literaturangaben
- Butler DS. The Sensitive Nervous System. Adelaide: Noigroup Publications; 2000.
- Shacklock M. Clinical Neurodynamics. Edinburgh: Elsevier; 2005.
- Butler DS. Mobilization of the nervous System. London: Churchill Livingstone; 1991.
- Coppieters MW, Butler DS. Do ‘sliders’ slide and ‘tensioners’ tension? An analysis of neurodynamic techniques and considerations regarding their application. Manual Ther.2007;doi:10.1016/j.math.2006.12.008.
- Breig A. Adverse Mechanical Tension in the Central Nervous System. Stockholm: Almqvist and Wiksell; 1978.
- Coppieters MW, Bartholomeeusen KE, Stappaerts KH. Incorporating nervegliding techniques in the conservative treatment of cubital tunnel syndrome. J Manipulative Physiol Ther. Nov-Dec 2004;27(9):560-568.
- Moseley, G. L., & Butler, D. S. (2017). Explain pain supercharged. The clinician’s handbook. Painos. Australia: Noigroup publication. Liite, 1(1), 1.
- Jesson, T. Radiculopathy, radicular pain and referred pain: what are we really talking about? In Touch (2018) 16-21.
- Coppieters MW, Butler DS. Do ‘sliders’ slide and ‘tensioners’ tension? An analysis of neurodynamic techniques and considerations regarding their application. Manual Ther. 2007;doi:10.1016/j.math.2006.12.008
- Greening J, Smart S, Leary R, Hall-Craggs M, O’Higgins P, Lynn B. Reduced movement of median nerve in carpal tunnel during wrist flexion in patients with non-specific arm pain. Lancet. 1999 Jul 17;354(9174):217-8. doi: 10.1016/s0140-6736(99)02958-x. PMID: 10421305.
- Dilley A, Lynn B, Greening J, DeLeon N. Quantitative in vivo studies of median nerve sliding in response to wrist, elbow, shoulder and neck movements. Clin Biomech (Bristol, Avon). 2003 Dec;18(10):899-907. doi: 10.1016/s0268-0033(03)00176-1. PMID: 14580833.
- Wright TW, Glowczewskie F Jr, Cowin D, Wheeler DL. Ulnar nerve excursion and strain at the elbow and wrist associated with upper extremity motion. J Hand Surg Am. 2001 Jul;26(4):655-62. doi: 10.1053/jhsu. PMID: 11466640
- Wright TW, Glowczewskie F Jr, Cowin D, Wheeler DL. Radial nerve excursion and strain at the elbow and wrist associated with upper-extremity motion. J Hand Surg Am. 2005 Sep;30(5):990-6. doi: 10.1016/j.jhsa.2005.06.008. PMID: 16182056.
- Beith ID, Robins, E J and Richards, P R An assessment of the adaptive mechanisms within and surrounding the peripheral nervous system, during changes in nerve bed length resulting from underlying joint movement. In: Shacklock MO, ed. Moving in on Pain. Australia: Butterworth-Heinemann; 1995.
- Dilley A, Lynn B, Greening J, DeLeon N. Quantitative in vivo studies of median nerve sliding in response to wrist, elbow, shoulder and neck movements. Clin Biomech. Dec 2003;18(10):899-907.
- Breig A. Biomechanics of the central nervous system. Stockholm: Almqvist and Wiksell; 1960.
- Troup JDG. Biomechanics of the lumbar spinal canal. Clin Biomech (Bristol, Avon). 1986;1:31-43.
- Millesi H, Zoch G, Reihsner R. Mechanical properties of peripheral nerves. Clin Orthop. May1995(314):76-83.
- Greening J, Dilley A, Lynn B. In vivo study of nerve movement and mechanosensitivity of the median nerve in whiplash and non-specific arm pain patients. Pain. 2005 Jun;115(3):248-53. doi: 10.1016/j.pain.2005.02.023. PMID: 15911151.
- Dilley A, Odeyinde S, Greening J, Lynn B. Longitudinal sliding of the median nerve in patients with non-specific arm pain. Man Ther. 2008 Dec;13(6):536-43. doi: 10.1016/j.math.2007.07.004. Epub 2007 Oct 2. PMID: 17913563.
- Greening J, Lynn B, Leary R, Warren L, O’Higgins P, Hall-Craggs M. The use of ultrasound imaging to demonstrate reduced movement of the median nerve during wrist flexion in patients with non-specific arm pain. J Hand Surg Br. 2001 Oct;26(5):401-6; discussion 407-8. doi: 10.1054/jhsb.2001.0582
- Erel E, Dilley A, Greening J, Morris V, Cohen B, Lynn B. Longitudinal sliding of the median nerve in patients with carpal tunnel syndrome. J Hand Surg Br. 2003 Oct;28(5):439-43. doi: 10.1016/s0266-7681(03)00107-4
- Dommisse GF. The blood supply of the spinal cord and the consequences of failure. In: Boyling J, Palastanga N, eds. Grieve’s Modern Manual Therapy. 2nd ed. Edinburgh: Churchill Livingstone; 1994.
- Lundborg G, Rydevik B. Effects of stretching the tibial nerve of the rabbit. A preliminary study of the intraneural circulation and the barrier function of the perineurium. J Bone Joint Surg Br. 1973 May;55(2):390-401. PMID: 4707307.
- Ogata K, Naito M. Blood flow of peripheral nerve effects of dissection, stretching and compression. J Hand Surg Br. 1986 Feb;11(1):10-4. doi: 10.1016/0266-7681(86)90003-3
- Nijs J, Van Houdenhove B, Oostendorp RA. Recognition of central sensitization in patients with musculoskeletal pain: Application of pain neurophysiology in manual therapy practice. Man Ther. 2010 Apr;15(2):135-41. doi: 10.1016/j.math.2009.12.001. Epub 2009 Dec 24. PMID: 20036180.
- Smart KM, Blake C, Staines A, Thacker M, Doody C. Mechanisms-based classifications of musculoskeletal pain: part 2 of 3: symptoms and signs of peripheral neuropathic pain in patients with low back (± leg) pain. Man Ther. 2012 Aug;17(4):345-51. doi: 10.1016/j.math.2012.03.003. Epub 2012 Mar 31. PMID: 22465002.
- Smart KM, Blake C, Staines A, Doody C. Clinical indicators of ‘nociceptive’, ‘peripheral neuropathic’ and ‘central’ mechanisms of musculoskeletal pain. A Delphi survey of expert clinicians. Man Ther. 2010 Feb;15(1):80-7. doi: 10.1016/j.math.2009.07.005. Epub 2009 Aug 12. PMID: 19679504.
- Santos FM, Silva JT, Giardini AC, Rocha PA, Achermann AP, Alves AS, Britto LR, Chacur M. Neural mobilization reverses behavioral and cellular changes that characterize neuropathic pain in rats. Mol Pain. 2012 Jul 29;8:57. doi: 10.1186/1744-8069-8-57. PMID: 22839415; PMCID: PMC3495676.
- Santos FM, Grecco LH, Pereira MG, et al. The neural mobilization technique modulates the expression of endogenous opioids in the periaqueductal gray and improves muscle strength and mobility in rats with neuropathic pain. Behav Brain Funct. 2014;10:19. Published 2014 May 13. doi:10.1186/1744-9081-10-19
- da Silva JT, Santos FM, Giardini AC, Martins Dde O, de Oliveira ME, Ciena AP, Gutierrez VP, Watanabe IS, Britto LR, Chacur M. Neural mobilization promotes nerve regeneration by nerve growth factor and myelin protein zero increased after sciatic nerve injury. Growth Factors. 2015 Feb;33(1):8-13. doi: 10.3109/08977194.2014.953630. Epub 2014 Dec 9. PMID: 25489629.
- Beneciuk JM, Bishop MD, George SZ. Effects of upper extremity neural mobilization on thermal pain sensitivity: a sham-controlled study in asymptomatic participants. J Orthop Sports Phys Ther. 2009 Jun;39(6):428-38. doi: 10.2519/jospt.2009.2954. PMID: 19487826.
- Nee RJ, Vicenzino B, Jull GA, Cleland JA, Coppieters MW. Neural tissue management provides immediate clinically relevant benefits without harmful effects for patients with nerve-related neck and arm pain: a randomised trial. J Physiother. 2012;58(1):23-31. doi: 10.1016/S1836-9553(12)70069-3. PMID: 22341379.
- Ellis RF, Hing WA. Neural mobilization: a systematic review of randomized controlled trials with an analysis of therapeutic efficacy. The Journal of manual & manipulative therapy. 2008;16(1):8-22
- Shacklock M. Neural mobilization: a systematic review of randomized controlled trials with an analysis of therapeutic efficacy. The Journal of manual & manipulative therapy. 2008;16(1):23-24.
- Rodríguez-Sanz D, López-López D, Unda-Solano F, Romero-Morales C, Sanz-Corbalán I, Beltran-Alacreu H, Calvo-Lobo C. Effects of Median Nerve Neural Mobilization in Treating Cervicobrachial Pain: A Randomized Waiting List-Controlled Clinical Trial. Pain Pract. 2018 Apr;18(4):431-442. doi: 10.1111/papr.12614. Epub 2017 Nov 20. PMID: 28734105.
- Jesson, T., Runge, N., & Schmid, A. B. (2020). Physiotherapy for people with painful peripheral neuropathies: a narrative review of its efficacy and safety. PAIN Reports, 5(5), 1-e834.
- Louw, Adriaan, et al. Pain neuroscience education: teaching people about pain. OPTP, 2018.
- Coveney B, Trott P, Grimmer K. “The upper limb tension test in a group of subjects with a clinical presentation of carpal tunnel syndrome.” Paper presented at: Tenth Biennial Conference: Manipulative Physiotherapists Association of Australia1997; Melbourne
- Coppieters MW, Bartholomeeusen KE, Stappaerts KH. Incorporating nerve gliding techniques in the conservative treatment of cubital tunnel syndrome. J Manipulative Physiol Ther. Nov-Dec 2004;27(9):560-568.
- Rozmaryn LM, Dovelle S, Rothman ER, Gorman K, Olvey KM, Bartko JJ. Nerve and tendon gliding exercises and the conservative management of carpal tunnel syndrome. J Hand Ther. Jul-Sep 1998;11(3):171-179.
- Siddiqui M, Karadimas E, Nicol M, Smith FW, Wardlaw D. Influence of X Stop on neural foramina andspinal canal area in spinal stenosis. Spine. Dec 1 2006;31(25):2958-2962.
- Fritz JM, Delitto A, Welch WC, Erhard RE. Lumbar spinal stenosis: a review of currentconcepts in evaluation, management, and outcome measurements. Archives of Physical Medicine & Rehabilitation. Jun 1998;79(6):700-708.
- Chang S-B, Lee S-H, Ahn Y, Kim J-M. Risk factor for unsatisfactory outcome after lumbar foraminal and far lateral microdecompression. Spine. May 1 2006;31(10):1163-1167.
- de Peretti F, Micalef JP, Bourgeon A, Argenson C, Rabischong P. Biomechanics of the lumbar spinal nerve roots and the first sacral root within the intervertebral foramina. Surg Radiol Anat.1989;11(3):221-225.
- Nakamichi K, Tachibana S. Restricted motion of the median nerve in carpal tunnel syndrome. J Hand Surg [Br]. Aug 1995;20(4):460-464
- Basson A, Olivier B, Ellis R, Coppieters M, Stewart A, Mudzi W. The Effectiveness of Neural Mobilization for Neuromusculoskeletal Conditions: A Systematic Review and Meta-analysis. J Orthop Sports Phys Ther. 2017 Sep;47(9):593-615. doi: 10.2519/jospt.2017.7117
- López López L, Torres JR, Rubio AO, Torres Sánchez I, Cabrera Martos I, Valenza MC. Effects of neurodynamic treatment on hamstrings flexibility: A systematic review and meta-analysis. Phys Ther Sport. 2019 Nov;40:244-250. doi: 10.1016/j.ptsp.2019.10.005
- Jesson, T. Sciatica: The Clinician’s Guide. Book 1: What Is It? Ebook (2021)
- Ryan C, Roberts L. ‘Life on hold’: The lived experience of radicular symptoms. A qualitative, interpretative inquiry. Musculoskelet Sci Pract. 2019 Feb;39:51-57. doi: 10.1016/j.msksp.2018.11.005. Epub 2018 Nov 23. PMID: 30500719.
- Nee, Robert J., and David Butler. “Management of peripheral neuropathic pain: integrating neurobiology, neurodynamics, and clinical evidence.” Physical Therapy in sport 7.1 (2006): 36-49
- Holmes SA, Barakat N, Bhasin M, Lopez NI, Lebel A, Zurakowski D, Thomas B, Bhasin S, Silva KE, Borra R, Burstein R, Simons LE, Borsook D. Biological and behavioral markers of pain following nerve injury in humans. Neurobiol Pain. 2019 Dec 4;7:100038. doi: 10.1016/j.ynpai.2019.100038. PMID: 31890990; PMCID: PMC6926375.
- Devor in McMahon SB, editor. Wall and Melzack’s textbook of pain. 6th ed. Philadelphia, PA: Elsevier/Saunders; 2013. 1153 p.
- Dilley A, Bove GM. Disruption of axoplasmic transport induces mechanical sensitivity in intact rat C-fibre nociceptor axons: Axoplasmic transport block causes axonal mechanical sensitivity. The Journal of Physiology. 2008 Jan 15;586(2):593–604.
- Satkeviciute I, Goodwin G, Bove GM, Dilley A. Time course of ongoing activity during neuritis and following axonal transport disruption. Journal of Neurophysiology. 2018 May;119(5):1993–2000.
- Devor M. Unexplained peculiarities of the dorsal root ganglion: Pain. 1999 Aug;82:S27–35.
- Howe JF, Loeser JD, Calvin WH. Mechanosensitivity of dorsal root ganglia and chronically injured axons: a physiological basis for the radicular pain of nerve root compression. Pain. 1977 Feb;3(1):25-41. doi: 10.1016/0304-3959(77)90033-1. PMID: 195255.
- Franson RC, Saal JS, J.A. S. Human disc phospholipase A2 is inflammatory. Spine. 1992;17 (Suppl):S129-S132.
- Saal JS, Franson RC, Dobrow R, al. e. High levels of inflammatory phospholipase A2 activity in lumbar disc herniation. Spine. 1990;15:674-678.
- Chen C, Cavanaugh JM, Song Z, Takebayashi T, Kallakuri S, Wooley PH. Effects of nucleus pulposus on nerve root neural activity, mechanosensitivity, axonal morphology, and sodium channel expression. Spine. 2004;29(1):17-25
- Miyamoto H, Doita M, Nishida K, Yamamoto T, Sumi M, Kurosaka M.Effects of cyclic mechanical stress on the production of inflammatory agents by nucleus pulposus and anulus fibrosus derived cells in vitro. Spine. 2006;31(1):4-9.
- Portland GH, Martin D, Keene G, Menz T. Injury to the infrapatellar branch of the saphenous nerve in anterior cruciate ligament reconstruction: comparison of horizontal versus vertical harvest site incisions. Arthroscopy. 2005;21(3): 281-285.
- Papastergiou SG, Voulgaropoulos H, Mikalef P, Ziogas E, Pappis G, Giannakopoulos I. Injuries to the infrapatellar branch(es) of the saphenous nerve in anterior cruciate ligament reconstruction with four-strand hamstring tendon autograft: vertical versus horizontal incision for harvest. Knee Surg Sports Traumatol Arthrosc. 2006;14(8): 789-793.
- Luo H, Yu JK, Ao YF, et al. Relationship between different skin incisions and the injury of the infrapatellar branch of the saphenous nerve during anterior cruciate ligament reconstruction. Chin Med J (Engl). 2007;120(13):1127-1130.
- Figueroa D, Calvo R, Vaisman A, Campero M, Moraga C. Injury to the infrapatellar branch of the saphenous nerve in ACL reconstruction with the hamstrings technique: clinical and electrophysiological study. Knee. 2008; 15(5):360-363.
- Cloward RB. Cervical Discography. Acta radiologica: diagnosis. 1963;1:675-688.
- Demircan MN, Asir A, Cetinkal A, et al. Is there any relationship between proinflammatory mediator levels in disc material and myelopathy with cervical disc herniation and spondylosis? A non-randomized, prospective clinical study. Eur Spine J. 2007;16(7):983-986
- Louw A, Schmidt SG. Chronic pain and the thoracic spine. J Man Manip Ther. 2015 Jul;23(3):162-8. doi: 10.1179/2042618615Y.0000000006. PMID: 26308707; PMCID: PMC4534852.
- Al Luwimi I, Ammar A, Al Awami M. Pathophysiology of Paresthesia. In: Imbelloni LE, editor. Paresthesia [Internet]. InTech; 2012 [cited 2019 Jul 21].
- Mahn F, Hüllemann P, Gockel U, Brosz M, Freynhagen R, Tölle TR, et al. Sensory Symptom Profiles and Co-Morbidities in Painful Radiculopathy. Priller J, editor. PLoS ONE. 2011 May 9;6(5):e18018.
- McMahon SB, editor. Wall and Melzack’s textbook of pain. 6th ed. Philadelphia, PA: Elsevier/Saunders; 2013. 1153 p.
- Franson RC, Saal JS, J.A. S. Human disc phospholipase A2 is inflammatory. Spine. 1992;17 (Suppl):S129-S132.
- Saal JS, Franson RC, Dobrow R, al. e. High levels of inflammatory phospholipase A2 activity in lumbar disc herniation. Spine. 1990;15:674-678.
- Kautio AL, Haanpaa M, Kautiainen H, Kalso E, Saarto T. Burden of chemotherapy-induced neuropathy–a cross-sectional study. Supportive care in cancer: official journal of the Multinational Association of Supportive Care in Cancer. 2011;19(12):1991-1996.
- Wijdicks CA, Westerhaus BD, Brand EJ, Johansen S, Engebretsen L, Laprade RF. Sartorial branch of the saphenous nerve in relation to a medial knee ligament repair or reconstruction. Knee Surg Sports Traumatol Arthrosc. 2009.
- Grace PM, Fabisiak TJ, Green-Fulgham SM, Anderson ND, Strand KA, Kwilasz AJ, Galer EL, Walker FR, Greenwood BN, Maier SF, Fleshner M, Watkins LR. Prior voluntary wheel running attenuates neuropathic pain. Pain. 2016 Sep;157(9):2012-23. doi: 10.1097/j.pain.0000000000000607. PMID: 27355182; PMCID: PMC4988888.
- Chen YW, Li YT, Chen YC, Li ZY, Hung CH. Exercise training attenuates neuropathic pain and cytokine expression after chronic constriction injury of rat sciatic nerve. Anesth Analg. 2012 Jun;114(6):1330-7. doi: 10.1213/ANE.0b013e31824c4ed4. Epub 2012 Mar 13. PMID: 22415536.
- Armada-da-Silva PA, Pereira C, Amado S, Veloso AP. Role of physical exercise for improving posttraumatic nerve regeneration. Int Rev Neurobiol. 2013;109:125-49. doi: 10.1016/B978-0-12-420045-6.00006-7
- Cobianchi S, Arbat-Plana A, Lopez-Alvarez VM, Navarro X. Neuroprotective Effects of Exercise Treatments After Injury: The Dual Role of Neurotrophic Factors. Curr Neuropharmacol. 2017;15(4):495-518. doi: 10.2174/1570159X14666160330105132. PMID: 27026050; PMCID: PMC5543672.
- Cooper MA, Kluding PM, Wright DE. Emerging Relationships between Exercise, Sensory Nerves, and Neuropathic Pain. Front Neurosci. 2016 Aug 23;10:372. doi: 10.3389/fnins.2016.00372
- Lopez-Alvarez VM, Puigdomenech M, Navarro X, Cobianchi S. Monoaminergic descending pathways contribute to modulation of neuropathic pain by increasing-intensity treadmill exercise after peripheral nerve injury. Exp Neurol. 2018 Jan;299(Pt A):42-55. doi: 10.1016/j.expneurol.2017.10.007. Epub 2017 Oct 7. PMID: 28993250.
